• 简介
• 合成和加工
• 神经肽释放、扩散和失活
• 受体活化
• 差异表达和加工多样性
• 多肽功能
• 疾病和药物开发
• 针对神经肽的抗体
• 神经肽产品和多肽激素
• 参考文献
神经肽是大脑中最大也是最多样化的信号分子。它们可以直接作为神经递质,可作为其它递质进行神经传递的调节器,在闭合细胞环境中可作为自身分泌或旁分泌调控者,也可作为长期激素分子(Burbach, 2011)。
神经肽由神经元合成及使用(Kastin, 2000, Russo, 2017)。它们起初被合成为大且无化学活性的前体蛋白,也叫前肽原(图1)。前肽原包含一个N端信号肽,它是新合成基因产品进入内质网腔所必需的。此信号序列在通过内质网膜时裂解,在内质网-高尔基体形成前肽,并进一步依次进入调节分泌通路(Burbach, 2011)。为了释放生物活性神经肽,前肽会被肽链内切酶和外肽酶进一步分解,并由例如糖基化、磷酸化作用、硫酸盐化作用、乙酰化作用、寡糖添加和N端焦谷氨酸盐的形成进行转录后修饰(Hook, 2008, Sun and Zhao, 2017, Mains and Eipper, 1999)。最常见的修饰是C端酰胺化(Eipper, 1992)。大约有一半的已知生物活性肽是α酰胺化物(图1)(Mains and Eipper, 1999)。
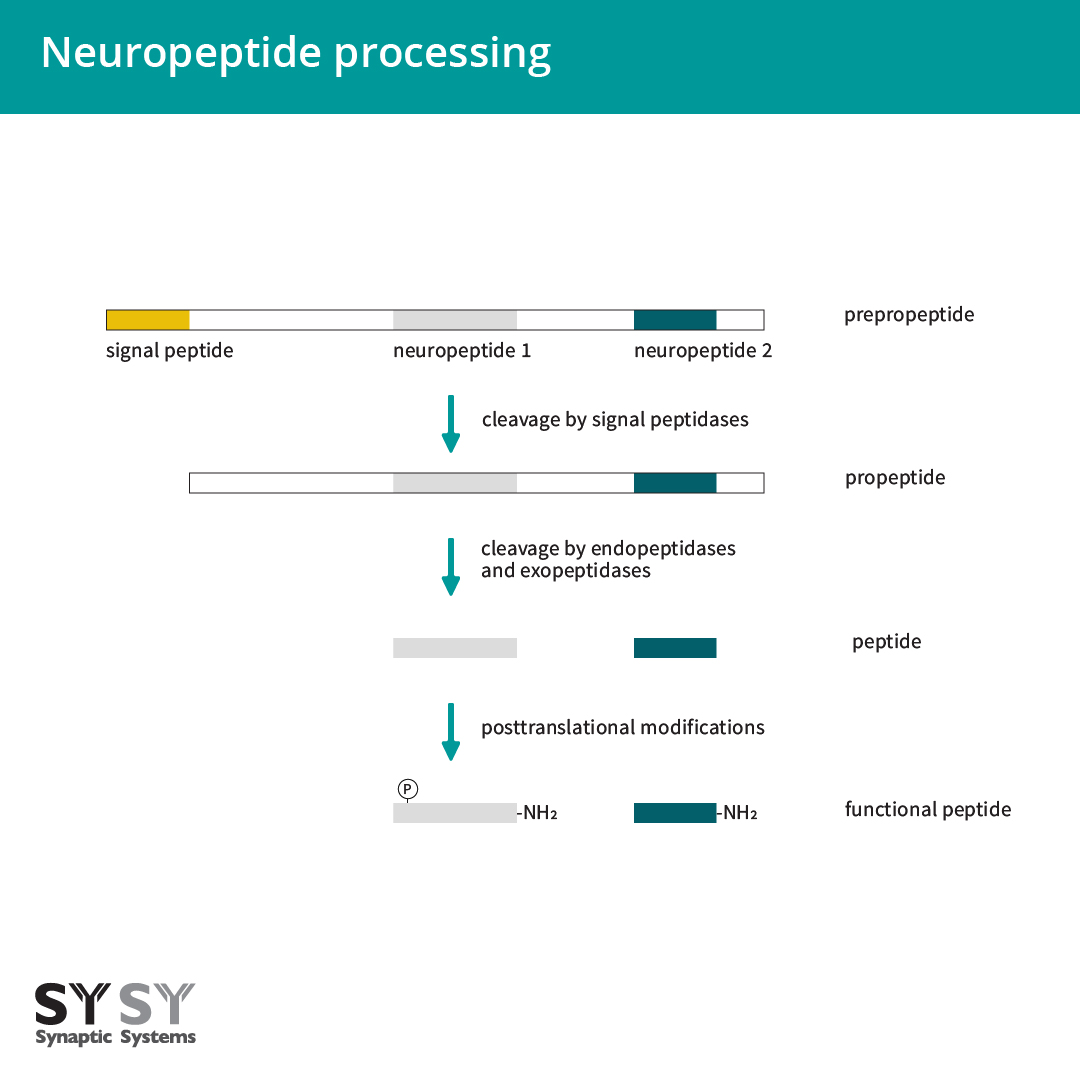
图1:神经肽合成。神经肽被合成为一部分大且无化学活性的前体蛋白,前肽原。一些蛋白水解裂解步骤和转录后修饰而形成生物活性肽。
内切蛋白水解裂解和转录后修饰既发生在反面高尔基体网络中,也发生在多肽被包装的密集核心囊泡中。密集核心囊泡可被运输及整个神经元并在突触间隙、细胞体中和沿着轴突释放多肽(Mains and Eipper, 1999, Russo, 2017)(图2)。
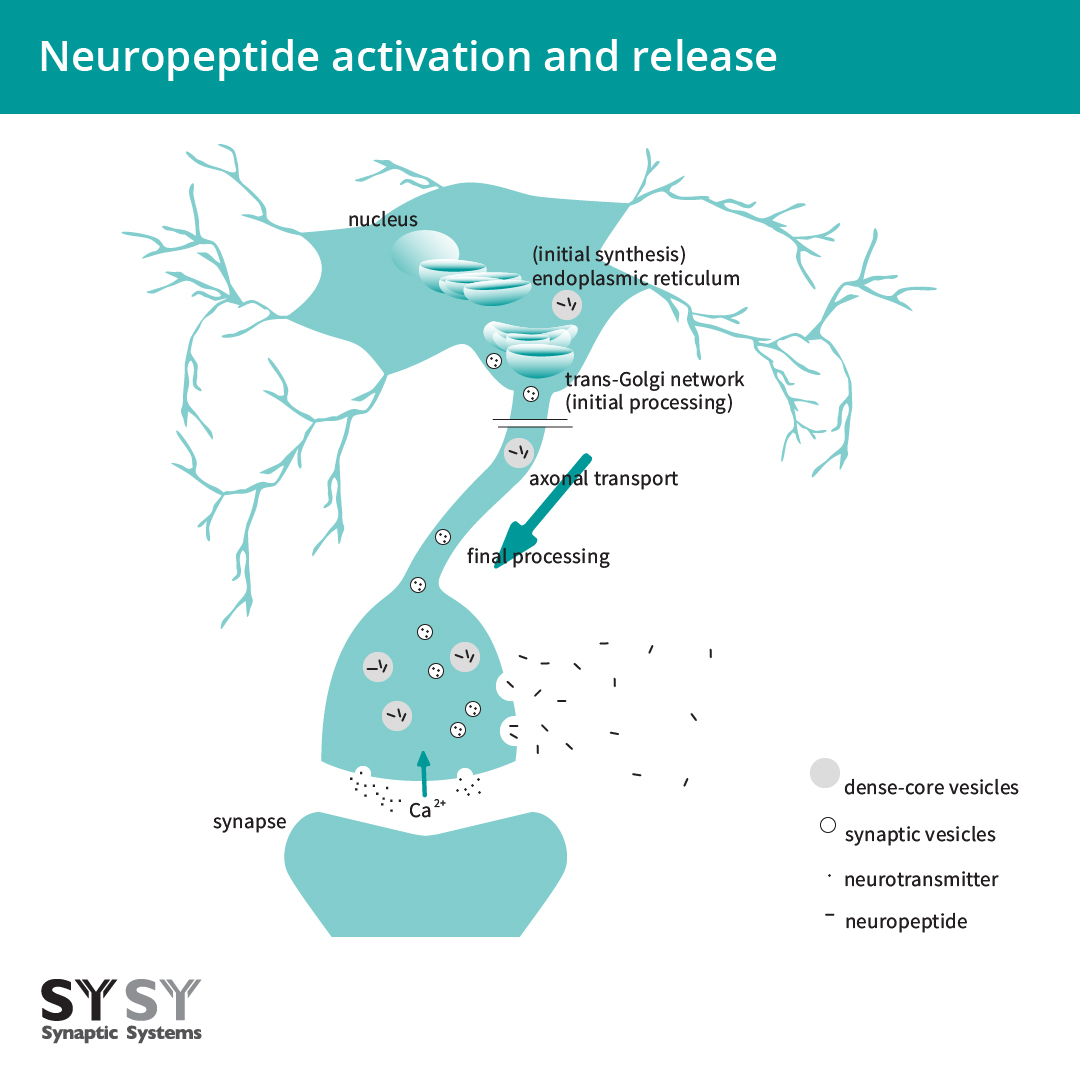
图 2:神经肽的活化和释放。神经肽最初在内质网中合成,在反面高尔基体网络和多肽被包装的密集核心囊泡中裂解和翻译后修饰。神经肽沿着轴突被转运进密集核心囊泡中,然后在Ca2+流入时释放并扩散分布。
神经肽通常与其它神经肽和神经递质在单个神经元中一起释放,从而产生多种影响 (Hökfelt et al., 2003, van den Pol, 2012)。在突触中,致密核心囊泡与突触囊泡共区域化包含典型神经递质例如谷氨酸盐(Russo, 2017)。虽然致密核心囊泡和突触囊泡经常一起释放,但他们的作用机制不同。在响应去极化或其它信号时,神经肽像神经递质一样通过钙离子胞吐作用而释放 (Russo, 2017)。然而,来自致密核心囊泡的神经肽比来自突触囊泡的神经递质的释放胞质钙离子浓度更低。传统神经递质的释放被认为发生在非常靠近钙离子进入位点,而神经肽通常会在离钙离子进入位点有一些距离的位置释放。因此,相对于钙离子流入位点,致密核心囊泡的位置更能控制分泌所需钙离子的量 (Mains and Eipper, 1999)。
与传统神经递质相反,神经肽从它们的释放位点扩散,因此可以在一个相对远的距离发挥作用(纳米到毫米)(图2)。这种由扩散作用驱动的分布被称为容积传递或传播 (van den Pol, 2012, Russo, 2017)。
由于没有多肽再摄取机制,因此它们仅可被从胞外空间慢慢移除。相反,传统神经递质可被特定转运蛋白从突触间隙快速移除 。容积传递和缺乏再摄取的结合有助于神经肽的相对持久作用(Russo, 2017)。
与神经递质相比,神经肽可长期存在,但它们的作用是有限的。胞外蛋白酶失活发生,在一些情况下甚至可以通过裂解已存在神经肽产生新的生物活性多肽(Russo, 2017)。
所有的神经肽可通过细胞表面受体作为信号传感器。几乎所有的神经肽都作用于G蛋白偶联受体,从而激发第二信使级联来调节细胞活动(Hökfelt et al., 2003, Russo, 2017)。例如肽配基,受体不仅广泛分布在神经系统中,也分布在许多其它组织中 (Hökfelt et al., 2003)。
跟神经递质受体相比(微摩尔级),神经肽受体具有相对较高的配体亲和力(毫微摩尔级)。这样,少量扩散的多肽仍然能够激活受体。再加上它们的长久的使用期使得神经肽可在相对低浓度和相对长距离下仍然具有活性(Russo, 2017)。
由于选择性剪切、串联组织或者前肽的细胞特异性分化的翻译后修饰过程,个别神经肽基因经常显示多种表型(Albrechtsen and Rehfeld, 2021)。
选择性剪切是在降钙素基因生成编码降钙素多肽或降钙素基因相关肽(CGRPs)的mRNAs时被发现的(Amara et al., 1982)。
对于某些神经肽,前肽经过不同的加工而生成不同长度的成熟肽,并在释放时带有相同的表位以跟受体结合(图3A)(Rehfeld et al., 2008)。虽然相同前体的不同产品可与相同受体结合,但它们的不同循环间隙会影响其效果。因此,proCCK是否主要被加工成CCK-33、CCK-12或CCK-8,或者促生长抑制素是否被加工成生长激素抑制素-28或生长激素抑制素-14时是相关的(Albrechtsen and Rehfeld, 2021)。
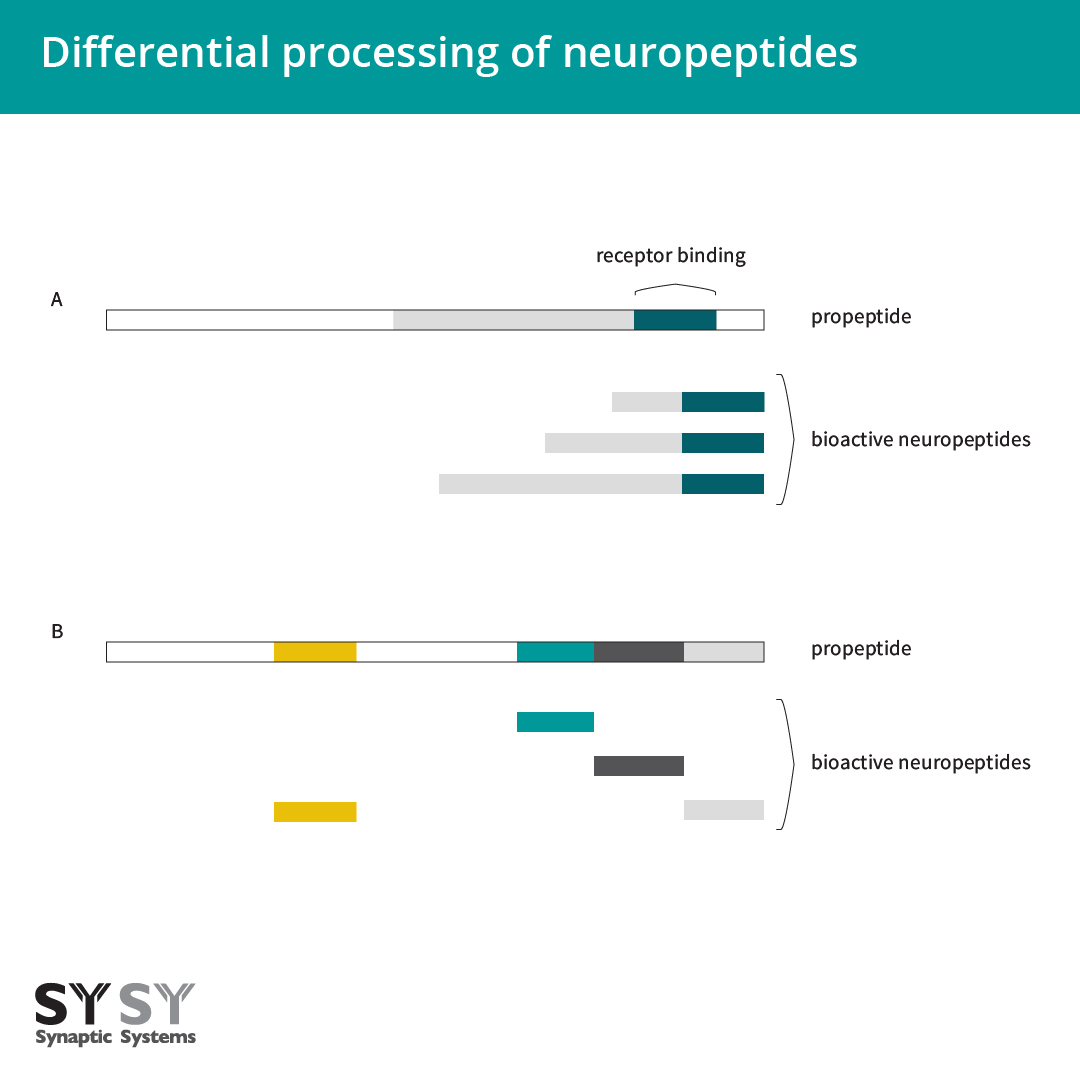
图 3:神经肽的分化过程。
A:对某些神经肽,前肽的分化过程导致不同长度的成熟多肽,但它们共享相同表位以跟受体结合。
B:在某些情况下,前肽包含不同的神经肽,它们在不同的组织中可被不同处理。
基因表达不同生物活性多肽的另一种方式发生在基因本身编码含有不同神经肽的前肽时(图3B),例如阿片肽基因和一些速激肽。这些具有相同前肽的多种神经肽可在多种组织中被不同处理(Albrechtsen and Rehfeld, 2021)。
神经肽在多种目标组织中作用。它们的作用可以是本地的,也可以是远距离的。因此,几乎所有的身体机能都可以被调节(Russo, 2017)。
许多具有相似结构的神经肽具有不同的功能。例如抗利尿激素和催产素是两种下丘脑调节肽,每种包含9个氨基酸(见图4A和4B中脑切片中IHC染色)。这两种多肽在7个残基中是完全相同的,并被认为早期进化中基因复制的结果。这两种多肽的作用是明显不同的:催产素会引起乳汁减少和子宫收缩,而抗利尿激素会导致肾脏积水和血管收缩(Mains and Eipper, 1999)。
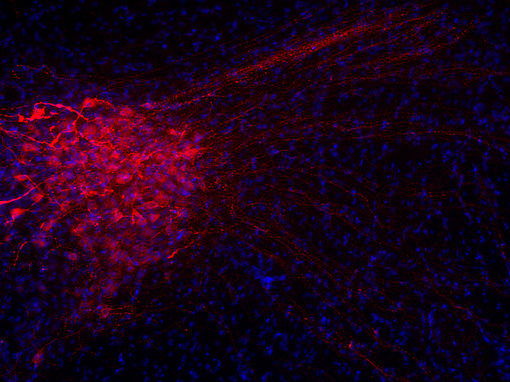
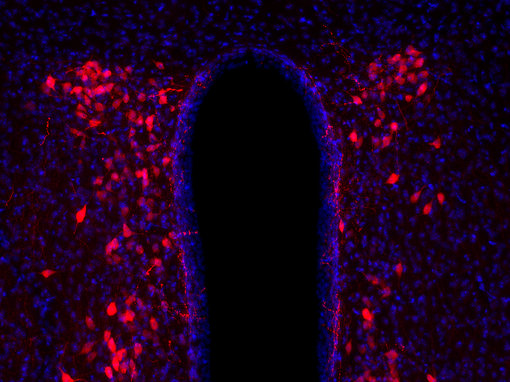
图4A:使用豚鼠抗-抗利尿激素抗体(cat. no. 403 004, 稀释比例 1:500, 红色),对经PFA固定的大鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图 4B:使用豚鼠抗-催产素抗体 (cat. no. 408 004, 稀释比例 1:500, 红色),对经PFA固定的小鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
神经肽在疼痛传递中一直备受关注。在转基因小鼠中的研究已经表明缺乏肽物质或其受体的小鼠不会对中度或剧烈疼痛响应(Hökfelt et al., 2003)。另一种多肽,降钙素基因相关肽(CGRP)在偏头痛的病理生理学中扮演者重要的角色(见图5A和5B中脊髓切片的染色)(Edvinsson et al., 2018, Russo, 2015)。
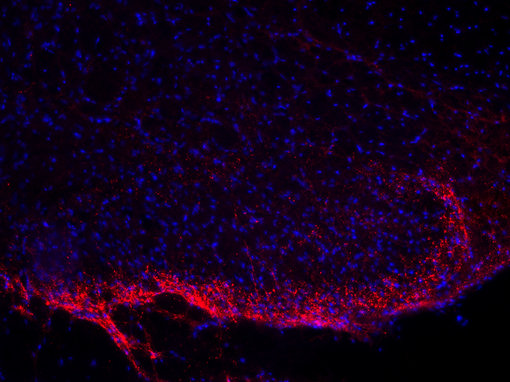
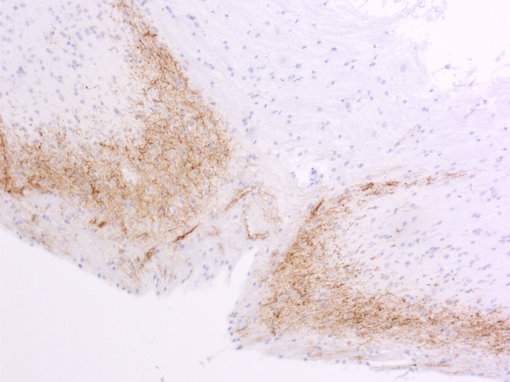
图5A:使用豚鼠抗-肽物质抗体 (cat. no. 459 005, 稀释比例 1:500,红色),对经PFA固定的大鼠脊髓切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图 5B:使用豚鼠抗-降钙素基因相关肽抗体(cat. no. 414 004, 稀释比例 1:1000, DAB),对经PFA固定、石蜡包埋的大鼠脊髓切片进行间接免疫染色。细胞核由苏木精复染为蓝色。
中枢神经系统对食物摄取的控制是另一个正在进行中的研究课题。神经肽Y促进碳水化合物的摄取,神经节肽促进脂肪摄取(见图6A和6B中脑切片的IHC染色)。刺鼠基因相关肽和食欲素也具有刺激效应。其它的神经肽,例如黑素皮质素和古柯碱及安非他明调控的转录会抑制进食(Hökfelt et al., 2003)。
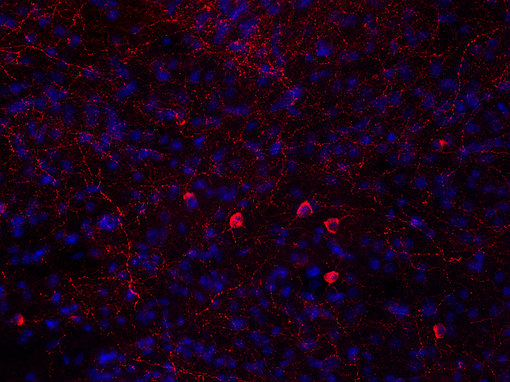
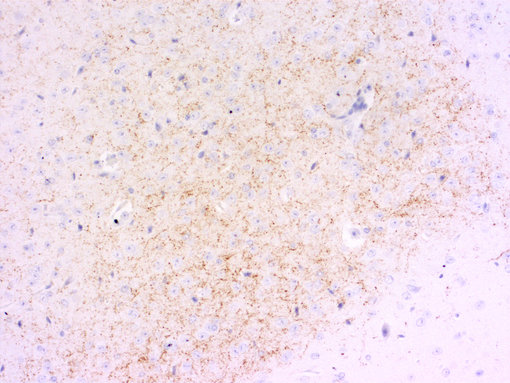
图6A:使用鸡抗-神经肽 Y 抗体 (cat. no. 394 006, 稀释比例 1:500, 红色),对经PFA固定的小鼠纹状体切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。染色之前进行了抗原修复(10mM Tris, 1mM EDTA, pH 9.0, 在 60°C下过夜) 。
图6B:使用豚鼠抗-神经节肽抗体 (cat. no. 446 004, 稀释比例 1 : 1000, DAB),对经PFA固定、石蜡包埋的小鼠下丘脑切片进行间接免疫染色。细胞核由苏木精复染为蓝色。
总之,神经肽的各种功能就像这组信号分子本身一样多种多样。所选的神经肽和它们的功能已在下面表格中列出:
| 神经肽 | 功能 |
| ACTH | 刺激皮质醇的产生和释放(Gallo-Payet, 2016)。 |
| AGRP | 刺激食欲和调控新陈代谢及能量消耗(Ilnytska and Argyropoulos, 2008)。 |
| CART | 调控进食、奖励和精神压力,可作为精神刺激剂(Rogge et al., 2008)。 |
| CCK-8 | 在消化、食物摄取、焦虑和恐惧的功能(Lee and Soltesz, 2011)。 |
| CGRP | 作用为血管舒张剂和伤害感受的传递(Benarroch, 2011)。 |
| CRF | 刺激促肾上腺皮质激素生成。决定妊娠期的时长和分娩时间(Vitoratos et al., 2006)。 |
| Galanin | 参与调控进食、渗透体内平衡、伤害感受、清醒/睡眠和认知(Lang et al., 2015)。 |
| Neuropeptide S | 参与调控清醒、焦虑和恐惧、食物摄取、学习和记忆(Grund and Neumann, 2019)。 |
| Neuropeptide Y | 在进食、能量储存、减缓压力、焦虑和疼痛感受、血压调控的功能(Reichmann and Holzer, 2016)。 |
| Neurotensin | 调控多巴胺通路、疼痛、体温、食欲、脂肪代谢和学习记忆(Saiyasit et al., 2018)。 |
| Orexin | 调控进食、睡眠、清醒和能量平衡(Nixon et al., 2015)。 |
| Oxytocin | 分娩和哺乳期间刺激平滑肌收缩,在社会联系和繁殖中起作用(Lee et al., 2009)。 |
| Somatostatin | 内分泌激素分泌的负调节因子(Gehete et al., 2010)。 |
| Substance P | 肠平滑肌收缩、血管舒张、中枢疼痛处理、神经性发炎、焦虑和压力(Schank and Heilig, 2017)。 |
| Vasopressin | 调控水体内平衡、血压和社会行为(Caldwell et al., 2008)。 |
| VIP | 刺激心脏收缩、血管舒张、调控血压和放松气管、胃及胆囊中的平滑肌(Iwasaki et al., 2019). |
大量神经肽和神经肽受体为药物靶标探索提供了许多机会。
食欲肽仅位于下丘脑外侧并分布于大脑的广泛区域(见图7A和7B中IHC图)。一些制药公司正针对这些系统开发治疗肥胖症的药物(Hökfelt et al., 2003)。
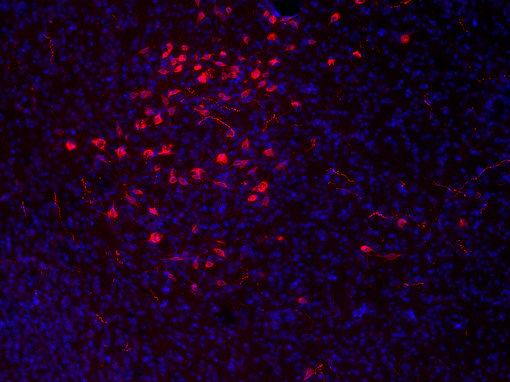
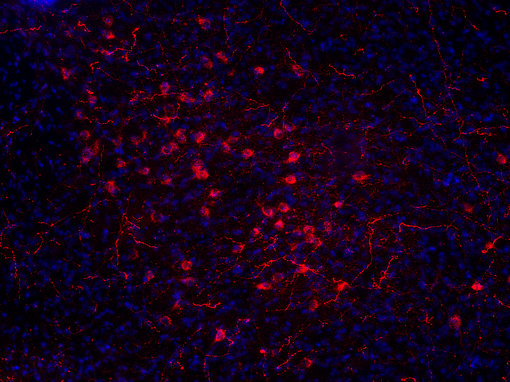
图7A:使用豚鼠抗-食欲素A抗体(cat. no. 389 004, 稀释比例1:500, 红色),对经PFA固定的小鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图7B:使用豚鼠抗-食欲素A/B抗体(cat. no. 389 104, 稀释比例1:500, 红色),对经PFA固定的小鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
在肽物质被发现70年后,第一种多肽药物,多肽拮抗剂被临床检测用来治疗抑郁症。多肽研究进展缓慢部分是由于合成选择性和有效穿透血脑屏障的激动剂或拮抗剂的困难(Hökfelt et al., 2003)。
最近,针对降钙素基因相关肽的单克隆抗体和其受体已被引进为偏头痛新的治疗方法。目前它们是通过阻断降钙素基因相关肽信号来预防偏头痛的最先进技术(Sevivas and Fresco, 2022, Vandervorst et al., 2021)。
总之,我们的目标是开发针对活性肽的抗体,利用加工的多肽或者裂解的活性多肽包括已知修饰来进行免疫。我们的抗体在免疫组织化学(IHC和IHC-P,如图8A和8B例证)或者免疫细胞化学(ICC)显示出了卓越的性能,对你的研究是极有价值的实验试剂!
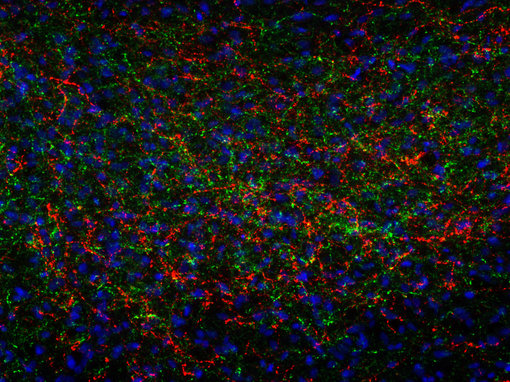
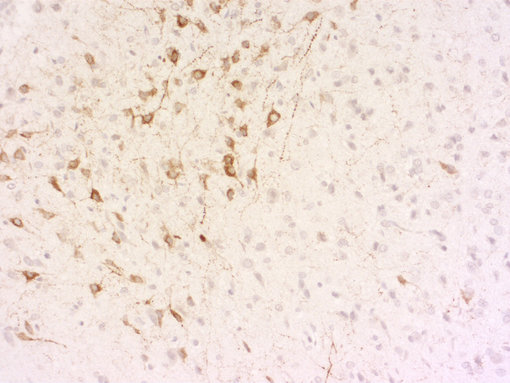
图8A:使用豚鼠抗-促肾上腺皮质激素抗体(cat. no. 452 005, 稀释比例 1:500, 红色)和鸡抗-神经肽Y抗体(cat. no. 394 006, 稀释比例1:500, 绿色),对经PFA固定的大鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图8B:使用豚鼠抗-生长激素抑制素-28抗体(cat. no. 366 004, 稀释比例1:500, DAB),对经PFA固定、石蜡包埋的大鼠下丘脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
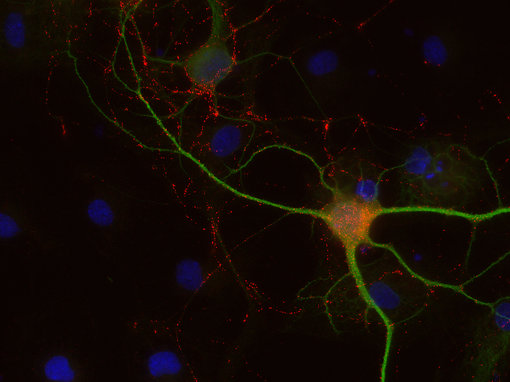
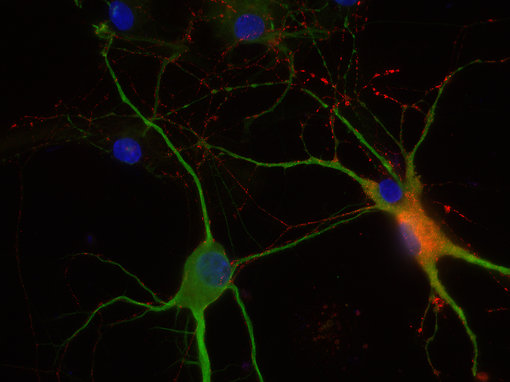
图8C:使用豚鼠抗-8肽胆囊收缩素抗体(cat. no. 438 004,稀释比例1:500,红色) 和兔抗-MAP 2抗体(cat. no. 188 002, 稀释比例1:1000, 绿色),对PFA固定的大鼠海马体神经元进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图8D:使用豚鼠抗-血管活性肠肽抗体(cat. no. 443 005, 稀释比例1:100, 红色)和兔抗-MAP 2 抗体(cat. no. 188 002, 稀释比例1:1000, 绿色),对经PFA固定的大鼠海马体神经元进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
| 452 005 | ACTH, Guinea pig, polyclonal, affinity purifiedaffinity | IHC IHC-P | 50 µg | US$465.00 | |
| 438 004 | CCK-8, Guinea pig, polyclonal, antiserumantiserum | ICC IHC IHC-P | 100 µl | US$375.00 | |
| 414 004 | CGRP, Guinea pig, polyclonal, antiserumantiserum | ICC IHC IHC-P iDISCO Clarity | 100 µl | US$370.00 | |
| 259 002 | Chromogranin A, rabbit, polyclonal, antiserumantiserum | WB | 200 µl | US$360.00 | |
| 259 003 | Chromogranin A, rabbit, polyclonal, affinity purifiedaffinity K.O. | WB ICC IHC IHC-P | 50 µg | US$460.00 | |
| 259-0P | Chromogranin A, control proteincontrol protein | 100 µg | US$110.00 | ||
| 259 103 | Chromogranin B, rabbit, polyclonal, affinity purifiedaffinity K.O. | WB ICC IHC IHC-P | 50 µg | US$380.00 | |
| 259-1P | Chromogranin B, control proteincontrol protein | 100 µg | US$110.00 | ||
| 529 004 | CRF, Guinea pig, polyclonal, antiserumantiserum | ICC IHC | 100 µl | US$370.00 | |
| 446 004 | Galanin, Guinea pig, polyclonal, antiserumantiserum | ICC IHC IHC-P | 100 µl | US$370.00 | |
| 468 003 | Ghrelin, rabbit, polyclonal, affinity purifiedaffinity | IHC IHC-P | 50 µg | US$380.00 | |
| 460 003 | GIP, rabbit, polyclonal, affinity purifiedaffinity discontinued, replacement: 514 003 | IHC IHC-P | 50 µg | ||
| 514 003 | GIP, rabbit, polyclonal, affinity purifiedaffinity | IHC IHC-P | 50 µg | US$380.00 | |
| 471 005 | GLP-1, Guinea pig, polyclonal, affinity purifiedaffinity | Dot blot IHC IHC-P | 50 µg | US$465.00 | |
| 471 203 | GLP-2, rabbit, polyclonal, affinity purifiedaffinity | Dot blot IHC IHC-P | 50 µg | US$380.00 |
Albrechtsen and Rehfeld, 2021: On premises and principles for measurement of gastrointestinal peptide hormones. PMID: 33811948
Amara et al., 1982: Alternative RNA processing in calcitonin gene expression generates mRNAs encoding different polypeptide products. PMID: 6283379
Benarroch, 2011: CGRP: sensory neuropeptide with multiple neurologic implications. PMID: 21768598
Burbach, 2011: What are neuropeptides? PMID: 21922398
Caldwell et al., 2008: Vasopressin: behavioral roles of an “original” neuropeptide. PMID: 18053631
Edvinsson et al., 2018: CGRP as the target of new migraine therapies – successful translation from bench to clinic. PMID: 29691490
Eipper, 1992: The biosynthesis of neuropeptides: peptide alpha-amidation. PMID: 1575450
Gahete et al., 2010: Somatostatin and its receptors from fish to mammals. PMID: 20633132
Gallo-Payet, 2016: 60 years of POMC: adrenal and extra-adrenal functions of ACTH. PMID: 26793988
Grund and Neumann, 2019: Brain neuropeptide S: via GPCR activation to a powerful neuromodulator of socio-emotional behaviors. PMID: 30112573
Hökfelt et al., 2003: Neuropeptides: opportunities for drug discovery. PMID: 12878434
Hook, 2008: Proteases for processing proneuropeptides into peptide neurotransmitters and hormones. PMID: 18184105
Ilnytska and Argyropoulos, 2008: The role of the Agouti-related protein in energy balance regulation. PMID: 18470724
Iwasaki et al., 2019: Recent advances in vasoactive intestinal peptide physiology and pathophysiology: focus on the gastrointestinal system. PMID: 31559013
Kastin, 2000: What is a neuropeptide? PMID: 10675912
Lang et al., 2015: Physiology, signaling, and pharmacology of galanin peptides and receptors: three decades of emerging diversity. PMID: 25428932
Lee and Soltesz, 2011: Cholecystokinin: a multi-functional molecular switch of neuronal circuits. PMID: 21154912
Lee et al., 2009: Oxytocin: the great facilitor of life. PMID: 19482229
Mains and Eipper, 1999: The Neuropeptides. Bookshelf ID: NBK28247 https://www.ncbi.nlm.nih.gov/books/NBK28247
Nixon et al., 2015: Sleep disorders, obesity, and aging: the role of orexin. PMID: 25462194
Rehfeld et al., 2008: The cell-specific pattern of cholecystokinin peptides in endocrine cells versus neurons is governed by the expression of prohormone convertases 1/3, 2, and 5/6. PMID: 18096669
Reichmann and Holzer, 2016: Neuropeptide Y: A stressful review. PMID: 26441327
Rogge et al., 2008: CART peptides : regulators of body weight, reward and other functions. PMID: 18802445
Russo, 2015: Calcitonin gene-related peptide (CGRP): A new target for migraine. PMID: 25340934
Russo, 2017: Overview of neuropeptides: Awakening the senses? PMID: 28485842
Saiyasit et al, 2018: Potential roles of neurotensin on cognition in conditions of obese-insulin resistance. PMID: 30279001
Schank and Heilig, 2017: Substance P and the Neurokinin-1 Receptor: The new CRF. PMID: 29056150
Sevivas and Fresco, 2022: Treatment of resistant chronic migraine with anti-CGRP monoclonal antibodies: a systematic review. PMID: 35659086
Sun and Zhao, 2017: Peptide hormones as tumor markers in clinical practice. PMID: 29054271
Van den Pol, 2012: Neuropeptide transmission in brain circuits. PMID: 23040809
Vandervorst et al., 2021: CGRP monoclonal antibodies in migraine: an efficacy and tolerability comparison with standard prophylactic drugs. PMID: 34696711
Vitoratos et al., 2006: “Reproductive” corticotropin-releasing hormone. PMID: 17308156