NanoTag Biotechnologies 和 Synaptic Systems 介绍了第一个PSD95 FluoTag-X2 抗体,它在标准免疫染色应用方面例如免疫组织化学(IHC) (图1) 和免疫细胞化学(ICC) (图 2)展现出了稳固而可靠的结果。并且,在附加的抗原提取步骤中,它对经PFA / 福尔马林固定的,来源于大鼠和小鼠的组织和细胞没有任何的要求。
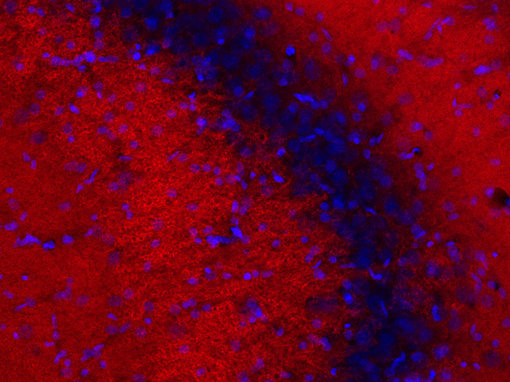
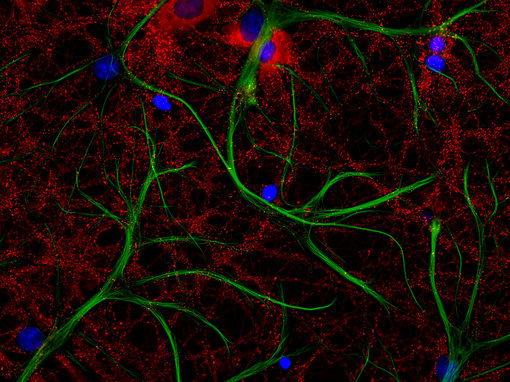
图1:用FluoTag-X2 抗-PSD95磺化Cy 3 抗体(cat. no. N3702-SC3-L,稀释比例1 : 500, 红色),对自由浮动的经PFA固定的大鼠海马体的振动切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
图2:用FluoTag-X2 抗-PSD95-ATTO 542 抗体(cat. no. N3702-At542-L, 红色)和FluoTag-X2 抗-GFAP-At488抗体 (cat. no. N3802-At488-L, 绿色),对经PFA固定的大鼠海马体神经细胞和星形胶质细胞进行间接免疫染色。细胞核由DAPI染色可见为蓝色
突触后致密区 (PSD) 是位于突触后膜,并列于突触前活跃区的一个特殊蛋白致密区。起初,通过电子显微镜,他被鉴定为位于突触后膜上的电子致密结构(图3)。突触后致密区在突触间隙充当支架结构,使神经递质受体聚集在靠近突触前释放神经递质的位置(Banker et al., 1974; Ziff, 1997; Dosemeci et al., 2016)。
由于大脑区域,活跃状况,突触成熟和一些神经变性的疾病,突触后致密区的大小和成分也有所不同(Meyer et al., 2014; Vyas and Montgomery, 2016)
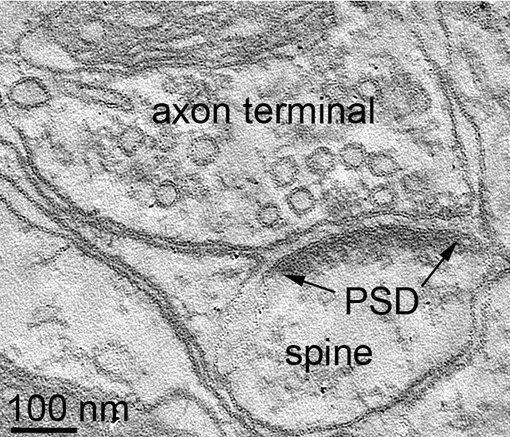
图3:大鼠海马结构突触的电子显微断层扫描图片
N. Holderith PhD 博士生
Laboratory of Cellular Neurophysiology,
Institute of Experimental Medicine
Budapest
图3:大鼠海马结构突触的电子显微断层扫描图片
N. Holderith PhD 博士生
Laboratory of Cellular Neurophysiology,
Institute of Experimental Medicine
Budapest
PSD95 (突触后致密区蛋白 95) 也称为SAP90 (突触关联蛋白 90)或者由DLG4基因编码的Disks large homolog 4 (Statthakis et al., 1997)。
与其邻近亲属PSD93, SAP102和SAP97,一同属于MAGUK 蛋白超级家族,并且共享PDZ, SH3和GUK结构域的特性(Woods and Bryant, 1993) (见图4)。
PSD95和PSD93 是PSD的关键组分(Hunt et al., 1996; Kennedy, 1997),可以形成包含数百个拷贝的多聚体支架,聚集神经递质受体、离子通道和其他伴随的信号蛋白(Dosemeci et al., 2016)。
出于此原因, PSD95是一个重要的,常用的标记蛋白,用于神经系统中突触后端的特定免疫标记,包括免疫细胞化学 (ICC)和免疫组织化学(IHC)。然而,由于多聚体的,紧凑且致密的结构,抗体表位经常被巨大的完整IgG抗体分子所掩盖或由于空间位阻而难以接近。抗原修复方法或者特殊调整过的固定实验方案可以改善结果,但由于附加的组织处理步骤,对于其它抗体在多路复用实验中的应用可能会是一个限制。
新的PSD95 FluoTag N3702是一个单域抗体(sdAb),通常被称为纳米抗体,由我们的合作伙伴公司NanoTag Biotechnologies所研制开发。这种重组骆驼源抗体仅由羊驼重链抗体的一个抗原结合位点组成。只有约仅仅15 kDa,这种FluoTag比传统的IgG抗体分子大约小10倍。由于非常小的尺寸,即使在标准的4% PFA灌注固定和后固定组织中,这种PSD95 FluoTag也可以稳定地访问其表位。这种组织制备方法由于确保了组织形态的极佳保存,并与大量可用的研究抗体兼容,所以通常用于振动和冷冻切片的免疫组化染色。
此外,在对人工培养神经元细胞的免疫组化染色中发现,新引入的PSD95 FluoTag在经PFA固定的细胞上表现卓越(图 2)。
它的单价结合特性,即每个FluoTag与确定数量的荧光团分子结合,使其成为定量分析的理想试剂。
为了确保最大范围的应用符合您的需求,我们新的PSD95 FluoTag可与一个广泛的荧光分子团共轭(见下表)
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
| N3702-AF568-L | PSD95 sdAb, camelid, monoclonal, FluoTag-X2FluoTag-X2, AZdye 568 | WB ICC IHC | 200 µl | US$515.00 | |
| N3702-AF647-L | PSD95 sdAb, camelid, monoclonal, FluoTag-X2FluoTag-X2, Alexa 647 | ICC IHC IHC-P | 200 µl | US$515.00 | |
| N3702-At488-L | PSD95 sdAb, camelid, monoclonal, FluoTag-X2FluoTag-X2, ATTO 488 | ICC IHC IHC-P | 200 µl | US$515.00 |
Banker et al. 1974: Proteins of the postsynaptic density. PMID: 4419608
Dosemeci et al. 2016: The Postsynaptic Density: There Is More than Meets the Eye. PMID: 27594834
Hunt et al. 1996: PSD-95 is associated with the postsynaptic density and not with the presynaptic membrane at forebrain synapses. PMID: 8778289
Kennedy 1997: The postsynaptic density at glutamatergic synapses. PMID: 9185308
Meyer et al. 2014: Balance and stability of synaptic structures during synaptic plasticity. PMID: 24742464
Statthakis et al. 1997: Human postsynaptic density-95 (PSD95): location of the gene (DLG4) and possible function in nonneural as well as in neural tissues. PMID: 9286702
Vyas and Montgomery 2016: The role of postsynaptic density in neural degeneration and regeneration. PMID: 27482211
Woods and Bryant 1993: ZO-1, DlgA and PSD-95/SAP90: homologous proteins in tight, septate and synaptic cell junctions. PMID: 8155583
Ziff 1997: Enlightening the postsynaptic density. PMID: 9427241