抗体可用作强大的诊断和科研工具,在许多不同的实验设置中如蛋白质印迹法、免疫细胞化学、免疫组织化学、免疫沉淀反应、酶联免疫吸附实验等等更多,它可以检测,分离或者可视化它们相应的抗原。在许多情况下,抗原是一种蛋白质,但是它也可以是一种化学修饰或者几乎任何其它小结构体或化合物。
长时间以来,抗体被誉为“神奇的子弹”,成千上万的研究人员每天仍在用它们在各种各样的应用中来识别和分离蛋白。但是在最近几年,抗体的名声已经被玷污了:抗体的交叉反应和变异性是主要的原因。“再现性危机”或者“抗体危机”即是这种现象的代名词。
我们在Synaptic Systems的目标是尽可能最好地刻画和验证我们的产品,从而提供具有最高质量和可靠性的抗体。我们所有的抗体都由自己生产,因此我们对批量测试和质量控制拥有全部的主动权。迄今为止,我们有五分之一的抗体是经过基因敲除或者基因敲落来验证的。我们正在力图提高这个数字,所以如果你有任何一个我们还没有测试过的抗体的基因敲除模型,请通过marketing@sysy.com联系我们。
一种主要成分为抗体的试剂的质量主要取决于两大特性:亲和性和特异性。
亲和性可衡量一个抗原表位和一个抗体的抗原结合位点之间反应的强度。一个抗体的亲和性越高,这种基于抗体测定的灵敏度就越高。特异性可衡量抗体在不同抗原之间的区别程度。这意味着即使是最好的抗体,也会有检测限制或者可能在特殊情况下显示假阳性结果。例如,如果一个高特异性和灵敏度抗体的目标抗原在被分析的样本中非常罕见,样本量通常会增多且抗体使用浓度也会升高来放大信号。如果样本中存在另一个可被该抗体弱结合的靶点,这种脱靶物和抗体本身不利的高浓度则会导致非特异性结合和假阳性结果。
由于抗原存在方式不同,因而不同的试验方法需要不同的抗体特性。在SDS-PAGE变性后的蛋白质印迹法检测中发现,抗原可能是氨基酸的线性延伸,而在免疫分离细胞、免疫沉淀或基于酶联免疫吸附(ELISA)的方法中,抗原则或多或少是原生结构。在免疫染色中,固定的细胞或组织中必须能够检测到交联的、化学修饰的结构。这意味着一种抗体可能在一种应用中表现出色,但在另一种应用中却完全失败。这也意味着一次检测的特异性不能保证在不同应用中的特异性。
必须独立地对所有的应用进行验证。
省略初级抗体
这是一种有用且重要的控制,可以检测由次级反应物造成的潜在背景。然而,这个试验没有对初级抗体的质量给出任何信息。
抗体信号与文献中数据保持一致
在蛋白质印迹法中观察到的分子量、组织分布和染色模式与文献中保持一致。这种验证方法虽然操作简单,却也有一些限制;如在蛋白质印迹法中条带的正确分子量不一定说明这个条带是你期望的靶蛋白。蛋白质印迹法中,很容易会有上百种蛋白跑出相同的速度,这样会导致结果的误解。文献中的数据也有可能是不正确的或者不完整的。
细胞转染可过度表达目标抗原
在一个仅表现出微弱或没有内源性表达的细胞系中过度表达目标蛋白时,可为一个抗体的特异性和敏感性提供一个基本的概念。通过这种方法,可评估同一蛋白不同亚型的反应活性。然而,人为的高水平靶蛋白通常并不能反映内源表达水平。组织或细胞裂解液中预期大小或定位的清晰信号,已知包含感兴趣的蛋白,同时在一个过表达系统中得到阳性结果,则是特异性的良好指标。
用免疫原阻断/预吸附抗体
尤其对多克隆免疫血清来说,这是一种非常有用的实验来确定一个观察到的信号是否与免疫的抗原有关。如果信号在预吸附后消失,那此信号具有特异性的概率极高。然而,不能排除与其它蛋白发生交叉反应的可能性,因为它们可共享一个相似的抗体结合表位(推荐的预吸附实验方案可在这里找到here。

图1:用多克隆豚鼠抗体cat. no. 443 004 在小鼠脾脏匀浆中检测Chil3/YM1。条带1:Chil3/YM1抗体(稀释比例,1:1000)。条带2:用5 µg 免疫原阻断Chil3/YM1抗体(稀释比例,1:1000。
图1:用多克隆豚鼠抗体cat. no. 443 004 在小鼠脾脏匀浆中检测Chil3/YM1。条带1:Chil3/YM1抗体(稀释比例,1:1000)。条带2:用5 µg 免疫原阻断Chil3/YM1抗体(稀释比例,1:1000。
基因敲除细胞系或组织
检测一个抗体的特异性的黄金标准。与野生型相比,基因敲除细胞系中信号的消失是特异性最可靠的证据。请记住在蛋白质印迹法中,一个成功的基因敲除验证不能保证在免疫染色等其它应用中的特异性。不幸的是,基因敲除细胞系或组织并不总是有效的。我们尽可能多地用基因敲除来验证我们的抗体。如果你有我们还未验证过的目标基因敲除系统,请与我们联系。
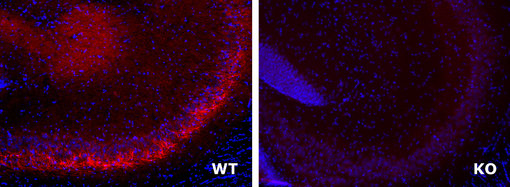
图2:用豚鼠抗体LAMP5 (cat. no.: 412 005, 稀释比例 1:500; 红色)对经PFA固定的野生型和基因敲除小鼠脑切片进行免疫染色。细胞核由DAPI染色可见为蓝色。
此致:感谢来自法国马赛发育生物学的M.-C. Tiveron 和H. Cremer为我们提供野生型和基因敲除小鼠脑切片。
图2:用豚鼠抗体LAMP5 (cat. no.: 412 005, 稀释比例 1:500; 红色)对经PFA固定的野生型和基因敲除小鼠脑切片进行免疫染色。细胞核由DAPI染色可见为蓝色。
此致:感谢来自法国马赛发育生物学的M.-C. Tiveron 和H. Cremer为我们提供野生型和基因敲除小鼠脑切片。
基因敲落细胞系或组织
对目标进行基因敲落(KD)也可以告诉你很多关于一个抗体特异性的信息。与基因敲除相比,通过RNAi下调一个蛋白经常更快,也更容易实现。与减少的mRNA水平保持一致的话,与对照系统相比,基因敲除模型中的信号或者染色也应该减少。但有时候基因敲落不是非常的高效,并且对于结果的解释也会比较困难。
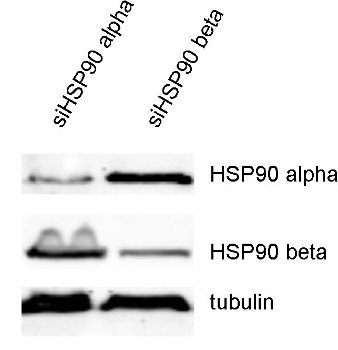
图3:用多克隆兔抗-HSP90 α抗体(cat. no.: 380 003)和多克隆兔抗-HSP90 β抗体 (cat. no.: 380 103)在野生型和基因敲落HeLaT-Rex 细胞中检测HSP90 α和β。
此致:在此感谢来自曼彻斯特大学生命科学学院的Silvia Dalba 和Stephen High教授。
图3:用多克隆兔抗-HSP90 α抗体(cat. no.: 380 003)和多克隆兔抗-HSP90 β抗体 (cat. no.: 380 103)在野生型和基因敲落HeLaT-Rex 细胞中检测HSP90 α和β。
此致:在此感谢来自曼彻斯特大学生命科学学院的Silvia Dalba 和Stephen High教授。
用于IP或ELISA应用的IP/MS验证
免疫沉淀反应(IP)与随后通过质谱分析(MS)进行的蛋白鉴定,对IP 或 ELISA应用中抗体特异性的分析是一个强大的工具。然而,这种方法不能提供关于在蛋白质印迹法或免疫染色等其它应用中抗体特异性的信息。
针对同一目标不同表位的抗体
这种验证方法对于一个抗体的特异性特别是在免疫染色或者蛋白质印迹法应用中,可贡献很有价值的数据。用针对同一目标但是不同抗原表位的抗体获得的对应染色模式为其特异性提供了很好的证据。不同的抗体与靶蛋白的不同部位结合,不大可能会有相同的非特定的结合伙伴。
蛋白质印迹法(WB)
在标准的蛋白质印迹法中,变性的蛋白质样品可被它们的分子质量通过SDS-PAGE分离并且转移到膜上。蛋白质印迹法可以提供非常有价值的分子量信息,从而可与理论计算和已发表的数据比较。
对不同器官、细胞类型和亚细胞组分如细胞膜与细胞溶质或者不同细胞器的分析,可能会为抗体特异性提供有用的信息。然而,这种关于不同表达模式必需的背景信息并不总是可用的。
免疫细胞化学(ICC)
这种方法不能为一个蛋白质的分子量提供任何信息。但是它可以观察到靶蛋白的亚细胞定位,这样就可以与文献相比较,或者通过与已知的阳性抗体对感兴趣区共染色来验证。不同细胞系统的使用对靶蛋白有不同的表达水平或模式,这对分析特异性非常有帮助。
免疫组织化学(IHC)
免疫组织化学或者对石蜡包埋样品的免疫组织化学(IHC-P)可帮助对组织特异性和靶蛋白的细胞和亚细胞表达模式的观察理解。虽然也无法提供分子量信息。但跟文献相比,原位杂交数据或者用与已知的阳性抗体对细胞类型或组织共染色是必须的。
免疫沉淀反应/酶联免疫吸附测定应用
在这些应用中,抗体必须能够识别目标分子在其天然构象具有特异性。
蛋白复合物在分析物中可能仍然完好,导致抗体表位的掩蔽。由于这些方法与变性的SDS-PAGE相当不同,从而很难比较生成的特异性数据。
然而,免疫沉淀反应物与已知抗体在蛋白质印迹中的分析可为免疫沉淀反应的特异性提供额外的信息。
如果你有一个基因敲除模型,抗体的验证是非常简单且容易的。如果这个黄金标准不可用,必须收集尽可能多的关于靶蛋白和抗体自身的信息和验证数据,从而保证抗体特异性的最大可能。